幾つかの選択肢があればその中でもより扱い易い細胞(培地の手配や培養において)、手に入り易い細胞といった点から選ばれているのだと思います。
私たちが主に使っているニワトリのBリンパ球由来のDT40細胞は、高効率に相同遺伝子組換えを起こす性質を持った細胞として1991年に報告され、比較的容易に遺伝子のノックアウトができる細胞として知られています。今ではゲノム編集技術を使えば、どのような細胞でも遺伝学ができるような体制になってきているみたいですが、、 とにかくこのDT40細胞の上記の性質を利用したいということで、実験手法に依存して選んだ細胞です。
さて、このDT40細胞で晴れてノックアウトが出来た!となると次は機能解析です。我々の研究対象である染色体分配に関与する動原体構成因子のノックアウト後に行う解析手法の一つとして、顕微鏡下での生細胞観察による染色体分配に与える影響の解析が挙げられます。通常、正常細胞は1時間程度でM期を通過するのですが、動原体構成因子のノックアウト細胞の多くはM期進行に異常が生じ、場合によっては半日近くM期に停止することもあり、顕微鏡下での生細胞観察は長時間に及びます。
生細胞観察を行うとき、みなさんが使用する細胞はおそらく接着系の培養細胞だろうと思いますが、このDT40細胞はBリンパ球由来ということで球状の浮遊系細胞なのです。浮遊系の細胞だと、培地内の微妙な温度変化による対流が生じるとすぐに視野からいなくなってしまい、実は生細胞観察の難易度はかなり高いです。しかし、ここで怯んではせっかく樹立した細胞が泣くと、極力温度変化の無い環境を目指して顕微鏡ごと37℃の恒温室に設置したシステムで観察を行う(大阪大学の平岡泰先生、神戸NICTの原口徳子先生の協力のもと)などして、長時間の生細胞観察をなんとか力技で行ってきました。それでも、35mmのガラスボトムディッシュを使った観察では、ちょっとした振動でも細胞が揺れてしまい、やはり難しい観察には変わりないという状況でした。
そんな中、96wellプレートでDT40細胞のコロニー形成を観察している時にふと、そういえばこの96well プレートのコロニーってプレートを結構大胆に動かしてもほとんど動かないよね、あっなるほど! ということで、96well プレートのウェルに近い形のガラスボトムディッシュを探してみました。
するとイメージ通りの中心に円柱状の小さなウェルがあるガラスボトムディッシュ(IWAKI #3971-001)が、なんと製品として売られているではありませんか! 早速、取り寄せて使ってみたところ予想通り細胞はほとんど動かず、一般的なディッシュ周りのインキュベーション装置で少なくとも1日程度の観察であれば全く問題なく行えることがわかりました。
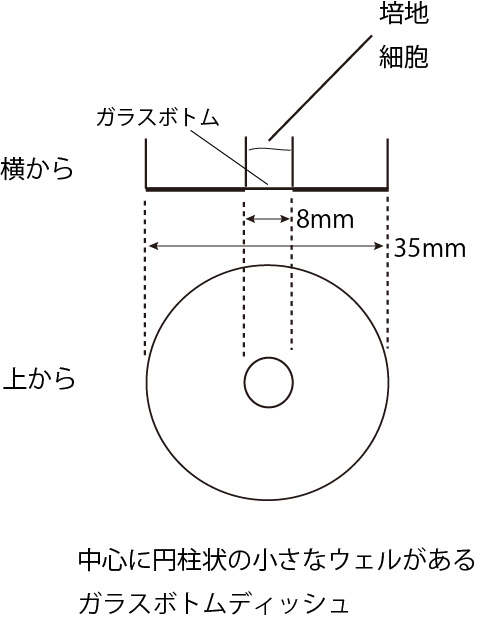
35mmのガラスボトムディッシュでは3ml程度の培地を使用するのに対して、円柱状の小さなウェル(φ8mm)には0.2mlの少量の培地を使用します。少量の培地だと温度差による対流が起こりにくいことに加え、狭い空間では培地の動きがかなり制限されるため細胞が動かないという理解です。後者に関しては直感的には分かるのですが原理に関しては少しあやふやで、培地の体積に対して「界面張力」の影響が増すから、ということでしょうか?
いずれにしても「コロンブスの卵」的なカイゼン術として、多点での生細胞観察やFRAP法によるタンパク質の動態解析にも利用するなど非常に重宝しています。浮遊系培養細胞での生細胞観察を考えている方はあまりいないのではと思いますが、このアイテムを知っておけば今後の選択肢の幅が広がること間違いなしです!


 2020
2020