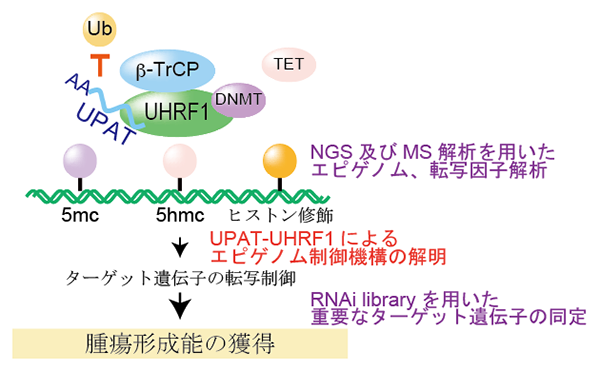
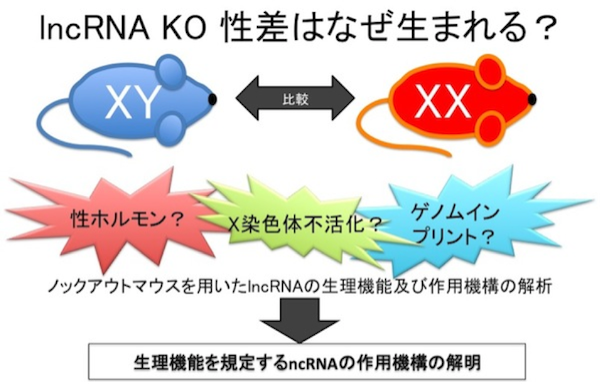
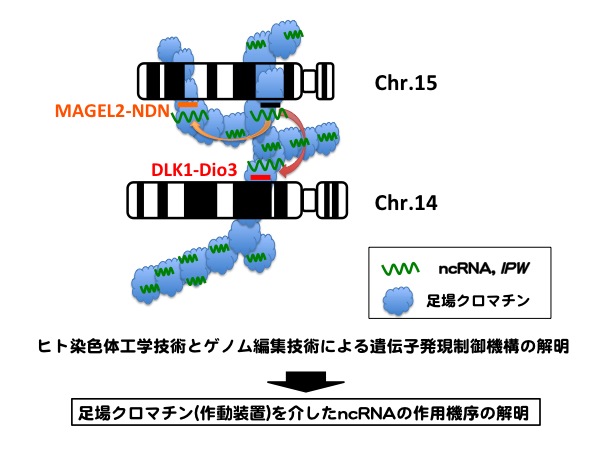
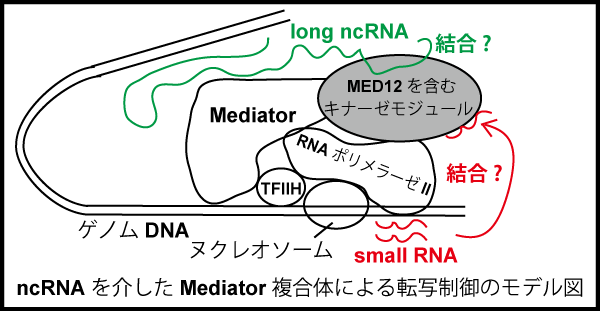
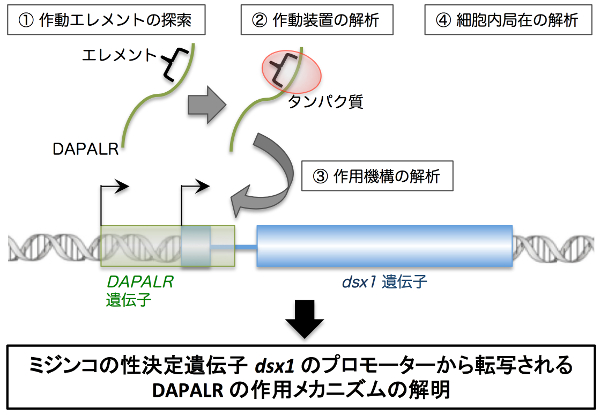
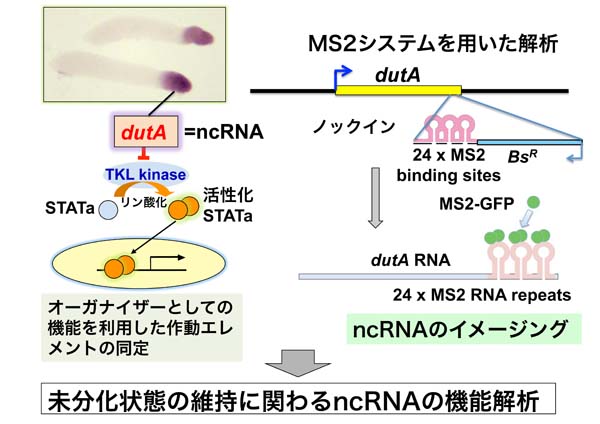
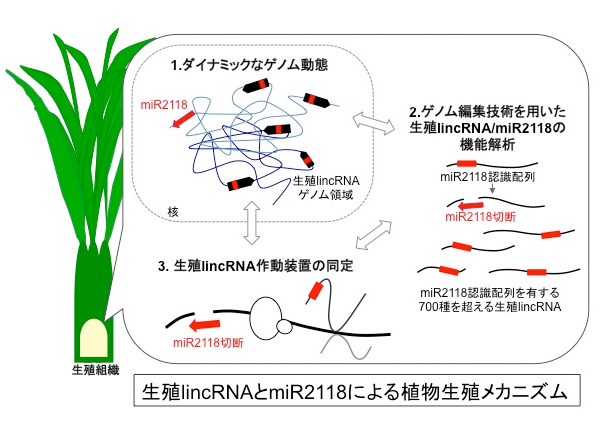
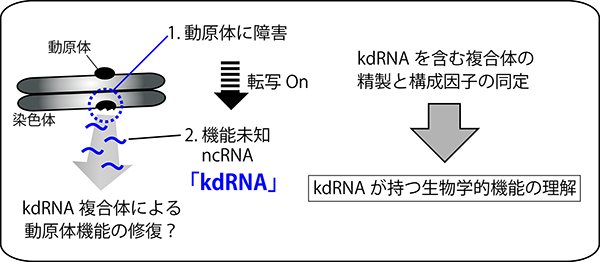
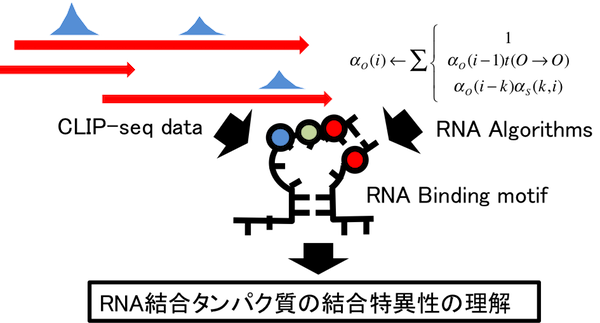
【公募研究1】ヘテロクロマチンの凝縮構造を作り出すノンコーディングRNA群の解明
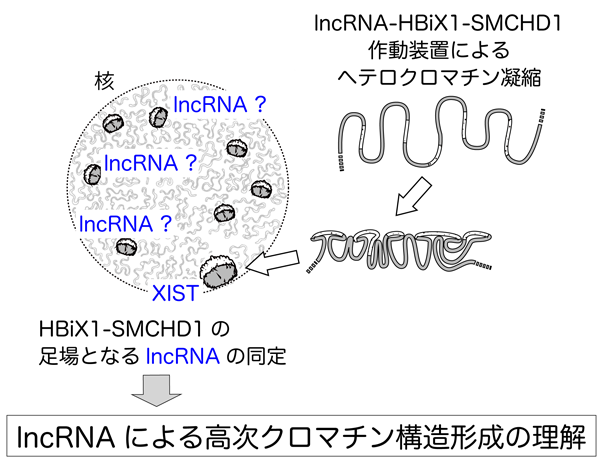
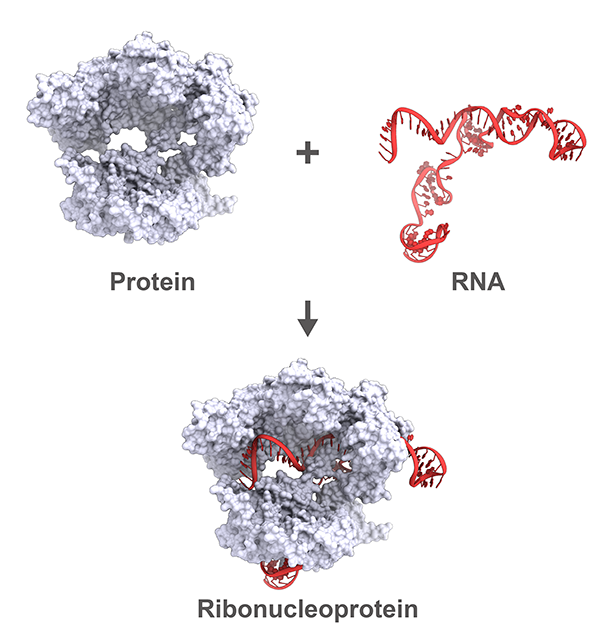
エピジェネティカルな遺伝子の発現制御の基盤となる高次クロマチン構造は、長鎖ノンコーディングRNA (lncRNA) にクロマチン制御タンパク質が結合することで作り出される、という例がいくつも知られています。その代表例、女性の不活性化されたX染色体は、XIST lncRNA依存的にバー小体と呼ばれる凝縮したクロマチン構造(ヘテロクロマチン)を形成します。私たちはXISTを足場とするこの凝縮構造が、HBiX1-SMCHD1タンパク質複合体によって行われていることを見いだしてきました。HBiX1-SMCHD1は、X染色体以外でもゲノムのさまざまな領域に結合していることから、HBiX1-SMCHD1はある一群のlncRNAを足場として、「ミニバー小体」とも呼べる凝縮クロマチン構造を核内のいたる所で形成していると考えられます。本研究では、この一群のlncRNAをHBiX1-SMCHD1複合体を基軸に同定することで、高次クロマチン構造におけるncRNAの機能を明らかにすることを目指します。