現在10月8日深夜、北海道には台風(既に低気圧にはなりましたが)が最接近しています。研究室から帰るタイミングを逃し、今日は外の暴風雨がおさまるまで研究室で篭城しようかと思っています。
そう、、ちょうど一ヶ月前の講習会もこんな台風の日でした。(記事を書くのが大変遅れて申し訳ありません。。)
当日、理研の中川研にずぶ濡れになって行った私を秘書さんと研究員さんがやさしく迎えてくれました。タオルをいただき、さらにスリッパまで買って来ていただきました。
しかし研究所の売店には女性もののスリッパしか置いていなかったらしく、それをはいて参加していた私を見て、講習会に参加していた他の参加者の方(○家さん)からは「そっちの方」かと思われていたらしいです。笑
さて、当研究室においてRNA-FISHや免染はよくおこなっていますが、超解像顕微鏡のサンプル調整は少し違うということ。
超解像顕微鏡のサンプル調整/観察をバリバリしている中川さんと水戸さんに直接その秘技を教えていただくため、この講習会に参加しました。
今回のプロトコールで間違いがありましたら、コメント/訂正お願いいたします。
in situ サンプル調整
(細胞固定〜Hybridization)
サンプルの用意
サンプルは、培養細胞を0.17 mmの厚さのカバーガラスの上に直接培養したものを用いる。カバーガラスの準備は以前の中川さんの記事を参照。
(サンプル調整(1)カバーグラスの準備 https://ncrna.jp/super-resolution/tips/item/46-2014-11-13-13-07-34, サンプル調整(2)カバーグラスの準備リバイス https://ncrna.jp/super-resolution/tips/item/52-2014-12-01-12-44-11 )
細胞の固定から透過処理まで
サンプルをProK処理する方法と処理しない方法がある。それぞれの利点は以前の中川さんの記事を参照。
(in situ hybridizationの簡易プロトコール https://ncrna.jp/super-resolution/tips/item/75-in-situ-hybridization )
試薬
今回、固定液以外の試薬は染色バットで作製した。液体の計量はピペットを用いるが、15 mlチューブなどでの計量でもいい。
また、メスアップにおいても染色バットに記した計量線を目印にデカントでおこなってもいい。
もし可能であれば、染色バットを試薬の数だけ用意しておくと、カバーグラスをセットしたホルダーを順々に浸して処理することができ作業が楽になる。
この講習後、さっそく当研究室でも購入させてもらいました。
左から染色バット タテ型 (アズワン : 2-3028-01)、染色バット タテ型壷 (2-3029-01)、磁製染色器 [ホルダー] (池本理化 : 803-131-11)。
固定液 : 4 % PFA / 1 x HCMF (用事調整)
いろいろな会社からPFAは販売されているが、溶けにくい商品などもある。HCMFはPBSよりも細胞にやさしいらしい (中川さん談)。Phenol redを加えることで視覚的にもpHを確認することができる。
•パラホルムアルデヒド [PFA] (メルク : 1.04005.1000)
•1 mol / L NaOH (ナカライ : 37421-05)
•1 mol / L HCl (ナカライ : 37314-15)
•10 x HCMF
NaCl 80.0 g
KCl 4.0 g
Na2HPO4(12H2O) 1.2 g
HEPES 24.0 g
NaOH 1.92 g
glucose 10.0 g / 超純水で1Lにする
滅菌した後に10 mgのphenol redを加える
① 500 mlビーカーにスターラーバーを入れ、超純水を400mlくらい入れておく
② 1 mol / L NaOHを5 ml加える
③ ドラフト内でPFAを20 gはかり、サランラップをかけて混ぜて溶かす
④ 10 x HCMFを50 ml加える
濃いピンクの液体になる
⑤ 1 mol / L HClを5 ml加えてpH=7.4に戻す
溶液がピンク色に変化する
⑥ 超純水でビーカーの目盛り500 mlに合わせる
室温で使用する (前日に作製した場合は4 ˚Cで保存し、使用前に室温に戻しておく)
0.2N HCl
100 mlの滅菌水を入れた染色バットに4 mlの濃塩酸を加えよく混ぜて、滅菌水で200 mlにする
ProK Buffer
染色バットに10mlの2M Tris-HCl (pH 8.0)と4 mlの0.5 M EDTAを加え、滅菌水で200 mlにする
ProK buffer用[左側]とProK液用[右側]の2つを作製し、37 ˚CのWater bathに入れておく
ProK液
•Proteinase K, recombinant, PCR Grade (ProK) (Roche : 3115887001)
ロットによって濃度が違うので注意する
使用直前にProKを最終濃度3 μg/mlになるようにProK Bufferに加えてスポイトなどでよく混ぜる
0.2 % グリシン / PBS
染色バットに0.4 gのグリシンを入れ、少量のPBSで溶かした後にPBSで200mlにする
アセチル化溶液
100 mlの滅菌水を入れた染色バットに0.5 ml (正確に)の濃塩酸を加えておく。使用直前に3 mlのトリエタノールアミン(粘性あり)と0.5mlの無水酢酸を加えよく混ぜ、滅菌水で200 mlにする
10 % Triton X-100 / PBS
染色バットに10 % Triton X-100を5 ml入れ、PBSを加えてよく混ぜ100 mlにする
手順
上記のとおり、染色バットを試薬の数だけ用意しておくと、カバーグラスをセットしたホルダーを順々に浸して処理することができ作業が楽になる。ただし、ホルダーを使用する場合はカバーガラスの表裏が分からなくなる場合があるので、細胞面をどちら向きに置くかルールを決めておいた方がいい。今回はホルダーの文字のある面の方に細胞面がなるようにカバーガラスを並べた。また複数のホルダーを使用する場合は、ホルダーの取っ手などに目印を付けていた方がいい。
ProK (+)処理
〜カバーガラス (18 mm øの丸形)の入った12 well plateの場合〜
1 mediumを捨て、固定液を1 ml / well加える
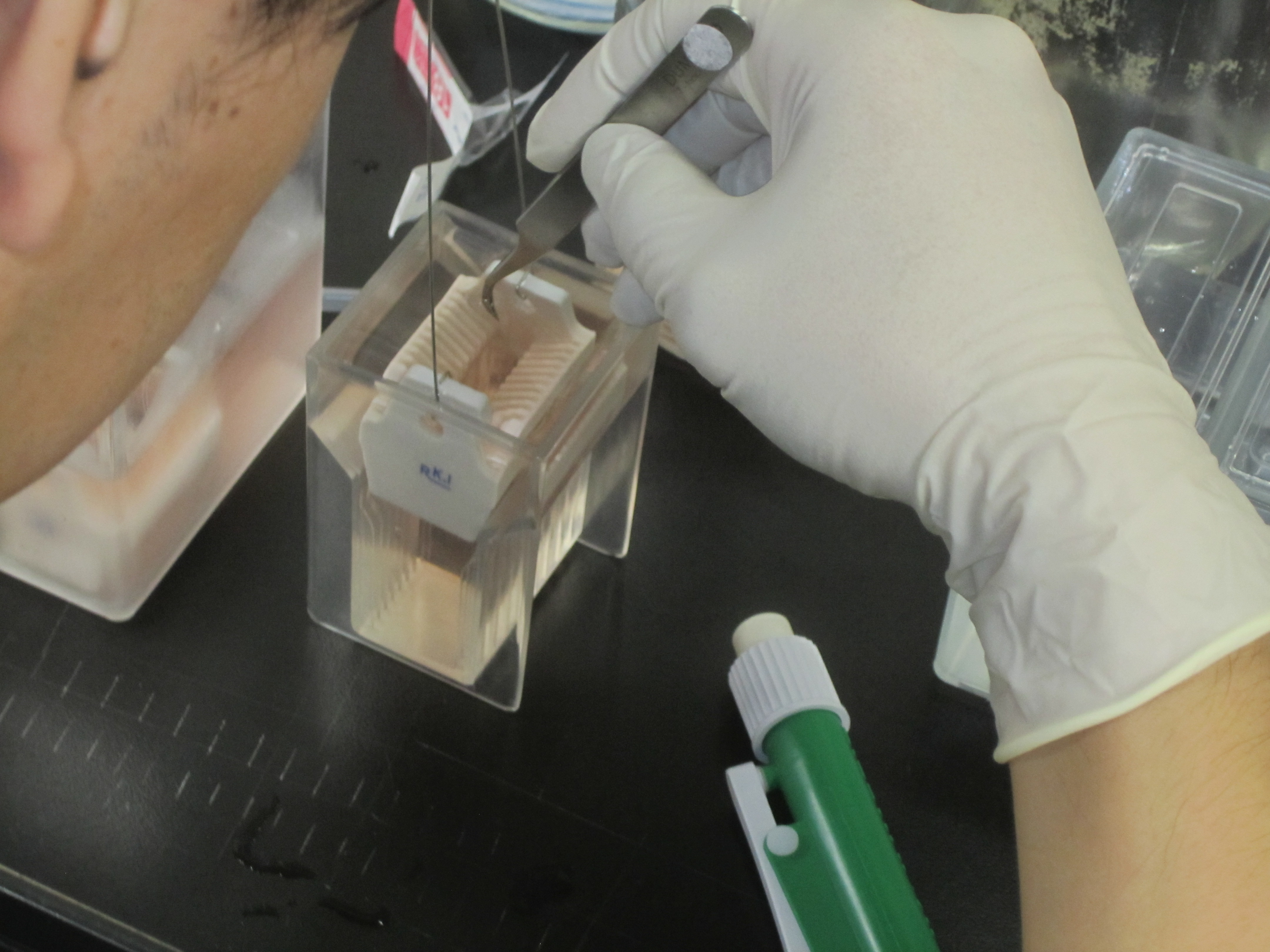
2 固定液中でホルダーにカバーガラスをセットする*1
4˚C overnight
3 ホルダーをPBSに移す
室温 5分間
4 ホルダーを滅菌水に移す
室温 5分間
5 ホルダーを0.2 N HClに移す
室温 20分間
6 ホルダーを滅菌水に移す
室温 5分間
7 ホルダーを37˚CのProK Bufferに移す
8 ホルダーを37˚CのProK液に移す
処理時間の目安 培養細胞 5分間
組織切片 7分間
9 ホルダーを0.2 % グリシン / PBSに移す
室温 10分間
10 ホルダーをPBSに移す
室温 5分間
11 ホルダーを固定液に移す
室温 20分間
12 ホルダーをPBSに移す
室温 5分間 x 2回
13 ホルダーを滅菌水に移す
室温 5分間
14 ホルダーをアセチル化溶液に移す
室温 15分間
15 ホルダーを滅菌水に移す
室温 5分間
(サンプルがカバーガラスからはがれやすい場合は16, 17をおこなう)
16 ホルダーを100 % エタノールに移す
室温 5分間
17 ホルダーを出し、風乾する
*1 ホルダーへのカバーガラスのセットには固定液を入れた「染色バット タテ型壷」を使用するとちょうどホルダーが上部に納まり、セットしやすい(上図)。
ProK (-)処理
〜カバーガラス (18 mm øの丸形)の入った12 well plateの場合〜
1 mediumを捨て、固定液を1 ml / well加える
2 固定液中でホルダーにカバーガラスをセットする
室温 10分間
3 ホルダーをPBSに移す
室温 5分間
4 ホルダーを0.5 % Triton / PBSに移す
室温 10分間
5 ホルダーをPBSに移す
室温 5分間
6 ホルダーを滅菌水に移す
室温 5分間
(Prehybridization~Hybridization)
プローブの作製は以前の中川さんの記事を参照。
(in situ hybridizationのプローブの作り方 https://ncrna.jp/super-resolution/tips/item/100-in-situ-hybridization )
プローブの非特異的な結合を防ぐため、トレイ(角シャーレの底面の裏側に番号を書いた紙を貼ったもの)を加熱台において作業を行う。
試薬
Prehybridization液 (50 % formamide, 1 x Dnehardt’s solution, 2 x SSC, 10 mM EDTA, 100 μg / ml yeast tRNA, 0.01 % Tween 20)
formamide 25 ml
50 x Denhardt’s solution 1 ml
20 x SSC 5 ml
0.5 M EDTA 1 ml
10 mg / ml yeast tRNA 500 μl
10 % Tween 20 50 μl / 滅菌水で50 mlにする -20˚C保存
Hybridization液 (Prehybridization液 + 5 % Dextran sulfate)
formamide 25 ml
50 x Denhardt’s solution 1 ml
20 x SSC 5 ml
0.5 M EDTA 1 ml
10 mg / ml yeast tRNA 500 μl
10 % Tween 20 50 μl
20 % Dextransulfate 12.5 ml / 滅菌水で50 mlにする -20˚C保存
humidified液 (2 x SSC, 50 % formamide)
20 x SSC 5 ml
formamide 25 ml / 滅菌水で50 mlにする -20˚C保存
50x Denhardt’s solution
Ficoll (type 400) 0.5 g
Polyvinylpyrrolidone 0.5 g
BSA 0.5 g / 滅菌水で50 mlにする
フィルター滅菌後、1 mlずつ分注して-20˚C保存
20 % Dextransulfate
Dextransulfate (SIGMA : D8906) 10 g 滅菌水で50 mlにする 4˚C保存
10 mg / ml yeast tRNA
yeast tRNA (SIGMA : R8759) 容器に直接滅菌水を入れて溶かす。溶けたら500 μlずつ分注して-20˚C保存
手順
1 トレイにひいたパラフィルム上にPrehybridization液を100μlずつドロップ (洗浄用のPrehybridization液は200μlドロップ)
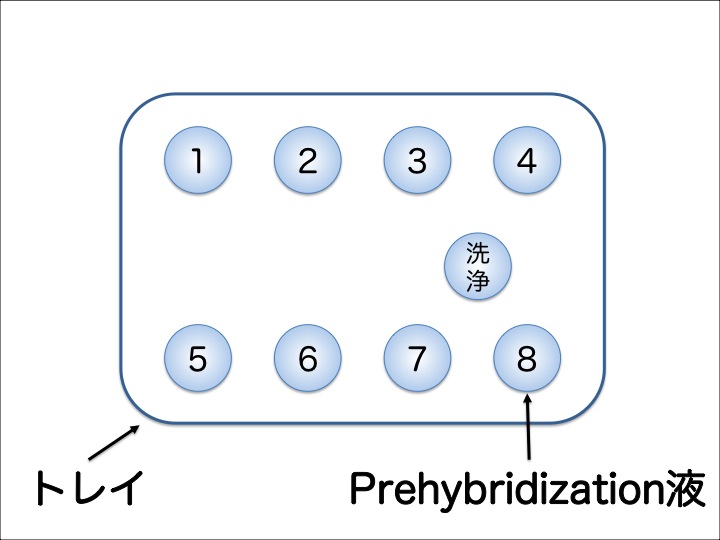
2 洗浄用のPrehybridization液のドロップにカバーガラスの細胞面を一度つけて洗浄する
3 新しいPrehybridization液のドロップに細胞面が下になるようにしてカバーガラスをかぶせる
4 トレイをサランラップで包み55 ˚Cで1-2時間保温する
(トレイの上蓋にhumidified solutionで濡らしたペーパータオルを貼り加湿する)
5 RNAプローブをHybiridization液で希釈し*2、75 ˚Cで10分間加熱する
6 トレイを70 ˚Cの加熱台に置き、パラフィルム上にプローブをドロップする*3
7 カバーガラスをプローブのドロップに細胞面が下になるようにしてかぶせる
8 トレイをサランラップで包み55 ˚Cで静置 overnight (16時間以上)
(Prehybridizationで使用したトレイの上蓋を再度使用して加湿する)
*2 希釈倍率はプローブによって異なる
1~10 μg/mlの間で調整する
超解像顕微鏡で観察する場合は濃いめで使用する
*3 18 mm øの丸形なら80 μlぐらい、18 mmの角形なら100 μlぐらい
一日目の作業は以上です。
最後にこの講習会を主催していただき、懇切丁寧に教えていただきました中川さん、水戸さん、中川研の皆様にお礼申し上げます。
また、参加にあたり旅費を支援していただきありがとうございました。

















 2020
2020