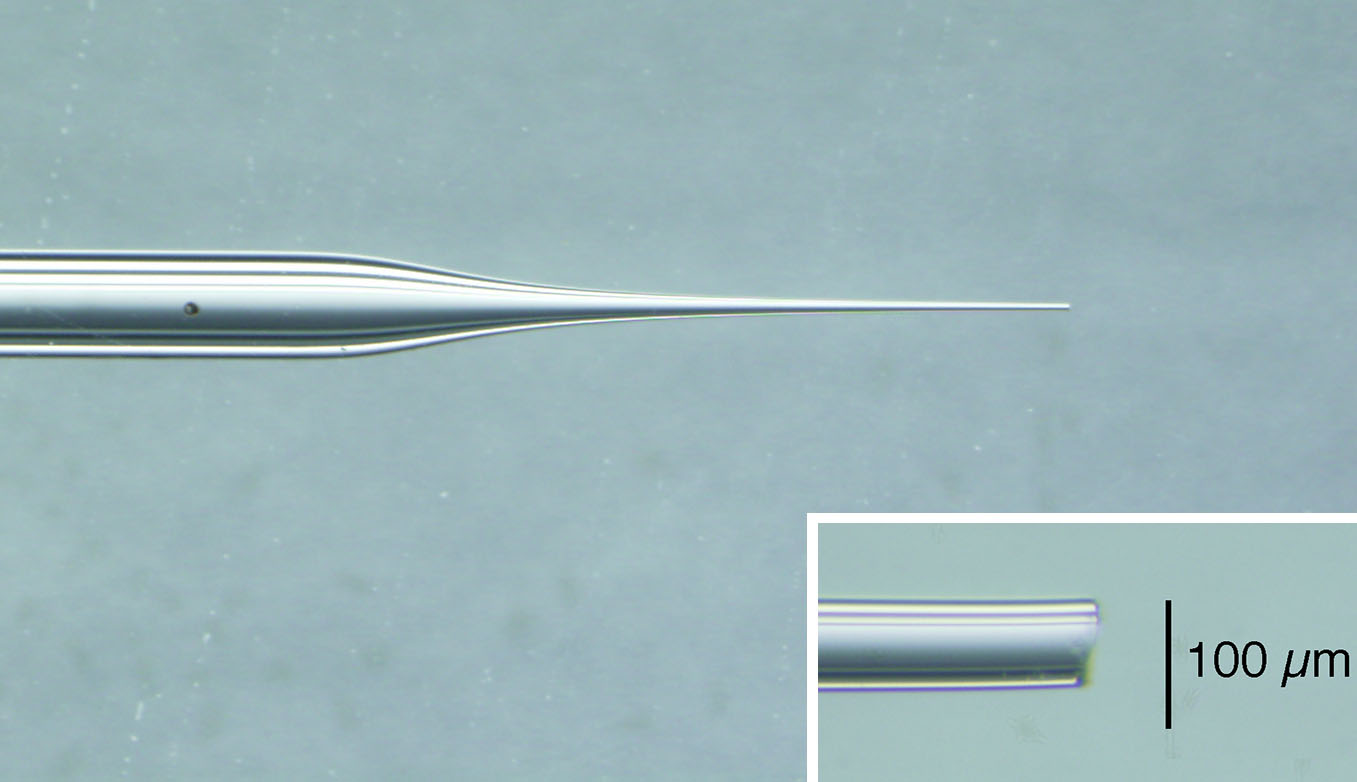
1. Needleの準備
インジェクションに慣れている人だと目で見てピンセットでポキッとするのが簡便かもしれませんが、慣れないと太すぎたり細すぎたりでなかなか良い針が作れません。卵管は意外と丈夫なので、細すぎると針がぐにゃりとなって刺さりませんし、刺さったとしても内圧に負けてなかなか液が入らず耳下腺炎になります。一方、あまり太すぎると刺さるには刺さるのですが、液漏れしてしまいます。プラーで決まった値で引いて、マイクロフォージで先端の太さをきちんと揃えた方が良いようです。先端を尖らせる必要はなくて、むしろ折ったままの平坦な形の方が、卵管に入れた時に向こう側に突き抜けない利点がある気がします。今のとこGD1をナリシゲのプラーで引いて、外径70 µmのところでマイクロフォージで折ったのが使いやすいです。
2. 溶液の準備
iGONADではCas9のタンパク質を高濃度で使用するため、trypan blueを入れると扱いにくくなるということでオリジナルの論文では色素なしでやってますが、さすがに初心者には辛すぎました。ニワトリエレポでよく使っていたFast greenだとそれほどCas9タンパク質と干渉しないようです。先っぽにちょこっとdyeを入れるだけで、操作性がかなり改善します。動画では分かりやすいように溶液に赤い色をつけてますが、本物のインジェクション溶液はここまで赤くないです。
こんな感じです。 pic.twitter.com/w25GcrvRBP
— Shinichi Nakagawa (@smoltblue) 2018年2月27日
3. インジェクションの場所の選定
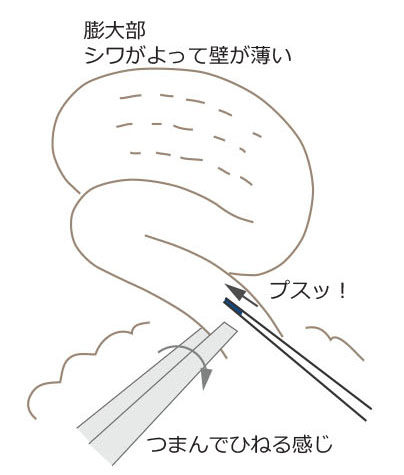
卵管のどこに打つのか。これがとても重要で、講習会の時にも詳しく教えてもらっていたのですが、卵管を見慣れていなかった当初は、教えてもらったことが何を意味するのかイマイチよくわかりませんでした。一番のポイントは「卵管膨大部」には決して針を入れてはならないというところだったのですが、確かに見慣れてくると膨大部の卵管壁は中が透けて見えるほど大変薄くなっており、そこに針を刺すとすぐに破れてしまって、入れた溶液がすぐ拡散してしまいます。膨大部から漏斗に向かって、ヘアピンカーブを2つ、あるいは3つ曲がった直線のところに打つのが良いようです。その辺りの卵管は膨大部と比べると白っぽく、分厚く、明らかに様子が違います。10匹ぐらい見てみて、ようやく雰囲気がつかめてきました。普段胚移植をされている方であればだれでもわかっていることなのでしょうが。
4. 手の固定
インジェクション時に手が震えて仕方がなかったのでマニピュレーターも使ってみたのですが、ダイナミックに動く卵管についていけず、やはり手でないと難しいようです。とはいえ、インジェクション中にちょっとでも手が震えると卵管壁を針先で傷つけてしまい、そこから液漏れします。いろいろ試した中で一番良かったのは、アルミホイルをふわっと丸めたものに手を乗せて、ちょうど自分が使う位置まで押し込んで型を作るというもの(紙粘土を握るのも有効でした)。こうすると、震えをかなり抑えることができます。また、最初はパスツールピペットを細工した先にゴムキャップを付けたものに針を刺していましたが(マイクロマニピュレーションでよく使われるやつ)、針をしっかりと固定した方が扱いやすく、ナリシゲのインジェクションホルダー(HI-7)を使うようにしたら操作性が劇的に向上しました。ただ、このあたりは好みにもよるかもしれません。また、マイクロマニピュレーション一般に言えることだと思いますが、手の位置(針の角度、ピンセットの角度)はしっかりと固定して、インジェクションする卵管の角度や位置の調節はマウスを回転させたり卵管をひねったりして調節するのが基本です。
A simple method to get steady hands for micro-manipulations.
— Shinichi Nakagawa (@smoltblue) 2017年12月1日
1) make a ball of aluminium foil
2) fold forceps (or needles) and crash the ball pic.twitter.com/1P8ritgvNa
5. インジェクション(1)針入れ
手も固定できて、ヘアピン2つ手前の直線の位置合わせもすんで、いざ針を刺そうとしても、これがなかなか刺さりません。卵管はゴムみたいにグニャグニャしてるので左手のピンセットで軽くつまんで固定してやって、そこにブスリと刺す感じです。僕は、刺す位置よりも上流側(漏斗側)をピンセットでつまみ、ブスリと押しこむような感じで入れてます。感覚的にはトリ皮に串を突き刺す時みたいな感じ。ここのところが一番手技的には難しく、卵管が手前にカーブしている時はまだやりやすいのですが、奥にカーブしている時はちょっとひねるようにして支えてやらないと、うまく支えることができません。いずれにせよ、フリーの状態の卵管には針は絶対に刺さらないということだけは、よくわかりました。
6. インジェクション(2)液入れ
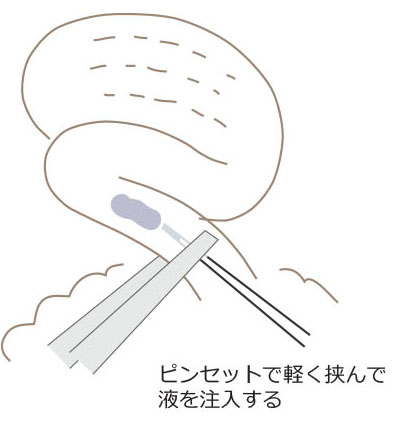
うまいこと刺さると、プスッという感じで針が動くので、そこから気持ち手前に引いてやります。そのままだと、卵管壁に針先がぶつかったままなので、無理やり液を入れようとすると内圧に負けて耳下腺炎になります。次にそろっとマウスピースに圧をかけて液を入れていくのですが、しばしば、卵管の下流でなく、上流の漏斗の方に向かって逆流してしまいます。そこで、インジェクション時に卵管を支えていたピンセットを離して、卵管壁の外から、針先をそっと押さえてやります。この時、ピンペットの先の平たい部分と針の方向が平行になるのが重要で、角度がついてるとポキリと折れて泣いてしまいます。また、新品のNo.5は針先がうまい具合に鴨のくちばしのように平らになっているので、この作業に適しています。僕は細かいダイセクション用にはNo.5のピンセットの針先を研いで使うことが多いのですが、そうするとうまく支えられません。そんなに強くつままなくても、ふわっと押さえるだけで、逆流を劇的に抑制することができます。
7. インジェクション(3)プニプニ
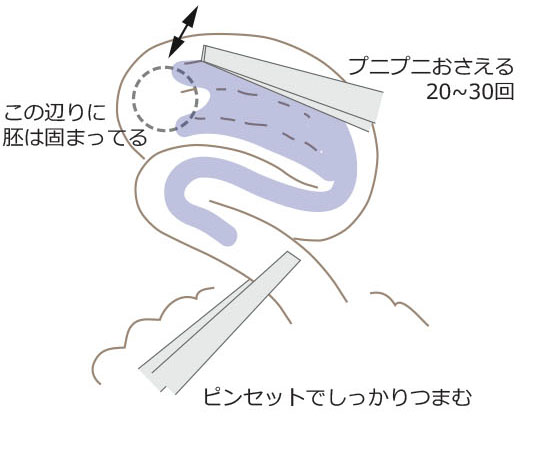
液を入れ終わったら針を抜くのですが、抜いた後、針先を支えていたピンセットでしっかりと卵管をつまんでやります。こうすると、全く液漏れしません。で、この先がとっても重要なのですが、空いた右手で新しいピンセットを持ち、ピンセットの先を閉じて膨大部のところをプニプニします。通常、受精卵は卵管部の下流側に溜まっているので、そのままではインジュイェクションした液がうまく行き渡りません。いい子、いい子、クリスパーのお風呂につかってね、と、受精卵を膨大部の中心部に戻すようにしながら50-100回プニプニすると、それまで白く抜けていた受精卵と卵丘細胞の塊のところに、液が染み渡って色が付いてくるのがわかります。この間、インジェクションした穴は左のピンセットでつまんだ上流にあるので、液が漏れてくることはありません。オリジナルのiGONADでは卵丘細胞が取れてきて膨大部もしぼんでくる夕方以降に実験するのが推奨されているのですが、マウス小屋のライトサイクルがちょっと違うのか、メスがshyでなかなか発情しないのか、僕のところでは夕方4時でも卵丘細胞にがっつり包まれて膨大部もバリバリに膨らんでいることが多いのですが、このプニプニもみもみをすれば、特に問題ないようです。むしろ、ステージ的には早い分、モザイクになりにくい、かもしれません。
8. エレポ
あとはキムワイプ片をかぶせて電極を添えてボンするだけなのですが、電極はNepageneのお椀型のタイプでやってます。電極のお椀にPBSをたっぷり含ませて卵管が完全に液に使っているような状態で電流を流した方が結果が安定するような気がしています。
9. その他
crRNAの調整: 2nmolスケールで注文:10 µlのannealing bufferに溶かす trRNAの調整:< 10nmolスケールで注文:50 µlのannealing bufferに溶かす duplexの調整:< 5 µl crRNA + 5 µl trRNA 95ºC 5min -1ºC 2sec x 60 ssODN: 4 nmolスケールで注文:4 µlのannealing bufferに溶かす インジェクション溶液の調整 Cas9 protein 1 µl Opti-MEM 5 µl duplex RNA 3 µl 37ºC 10 min + 1 µl ssODN
これで大体10匹分ぐらいあります。蒸発が嫌なので、0.2 mlのPCRチューブで全て混ぜた後、上にPCR用のミネラルオイルを10 µl程度乗せてます。こうすると保存中も全く量が変わりませんし、4ºCで1週間ぐらい置いといても全然問題なく使えました。マウスのコロニーが大きくない時はなかなか一度にプラグがつきませんが、こうして保存しておけば、いつでも使えるので便利です。上にも書いてますが、色素は溶液に入れず、インジェクションの度にちょこっと先につけてます。
また、針は卵管ごとに交換した方が良いようです。ちょっとでも先が詰まると溶液が極端に入れにくくなりますし、卵管にも差しづらくなります。これ、結構重要でした。一回目にプスリと気持ちよく入って良い針だからといって使い回すと、先が詰まって全然入らず耳下腺炎に、、、
というわけで、初期の頃は耳下腺炎との戦いだったわけですが、何のことはない。やり方が悪かっただけなんですね。最初はこれで本当にうまくいくのかとても不安でしたが、うまく行き出すとほいほいできるので、皆様も是非お気軽にお試しください。感覚的には、昔やってたニワトリの眼胞エレポやアフリカツメガエルのインジェクション並の手間でゲノム編集マウスが得られる感じです。手軽なだけでなく効率が良いのもiGONADのすごいところで、単純in-delはほぼ100%入ってますし、20塩基ぐらいのssODNベースのノックインであればわんさかホモ個体が取れてくる感じです。すごい方法を考える方がいるものだなあと、つくづく思います。


 2020
2020